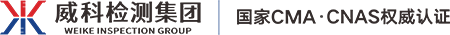-
医用材料
-
植入材料和人工器官
-
口腔科设备及材料
-
介入器材
遗传毒性试验
遗传毒性试验是用来检测化学物质对遗传物质的毒性作用的实验方法,主要包括基因突变和染色体畸变等检测。这些实验方法可以评估化学物质对DNA和染色体的损伤程度,从而预测其可能对人体造成的遗传毒性风险。在实验过程中,需要使用标准化试验方法,遵循GLP原则,以保证实验结果的准确性和可靠性。遗传毒性试验对于评估化学物质的致癌性和致畸性具有重要意义,可以为化学品的安全性评估和风险评估提供依据。
遗传毒性试验的目的和意义如下:
目的:
1、检测化学物质对遗传物质的毒性作用,评估其可能对人体造成的遗传毒性风险。
2、预测化学物质可能导致的基因突变和染色体畸变等遗传学损伤。
意义:
1、评估化学物质的致癌性和致畸性,为化学品的安全性评估和风险评估提供依据。
2、预测化学物质可能对生殖细胞产生的非整倍体潜在性,为生殖健康和人类遗传学的风险评估提供依据。
3、为制定人类接触化学物质的限制剂量提供科学依据,以保护人体健康和安全。
细菌回复突变试验:
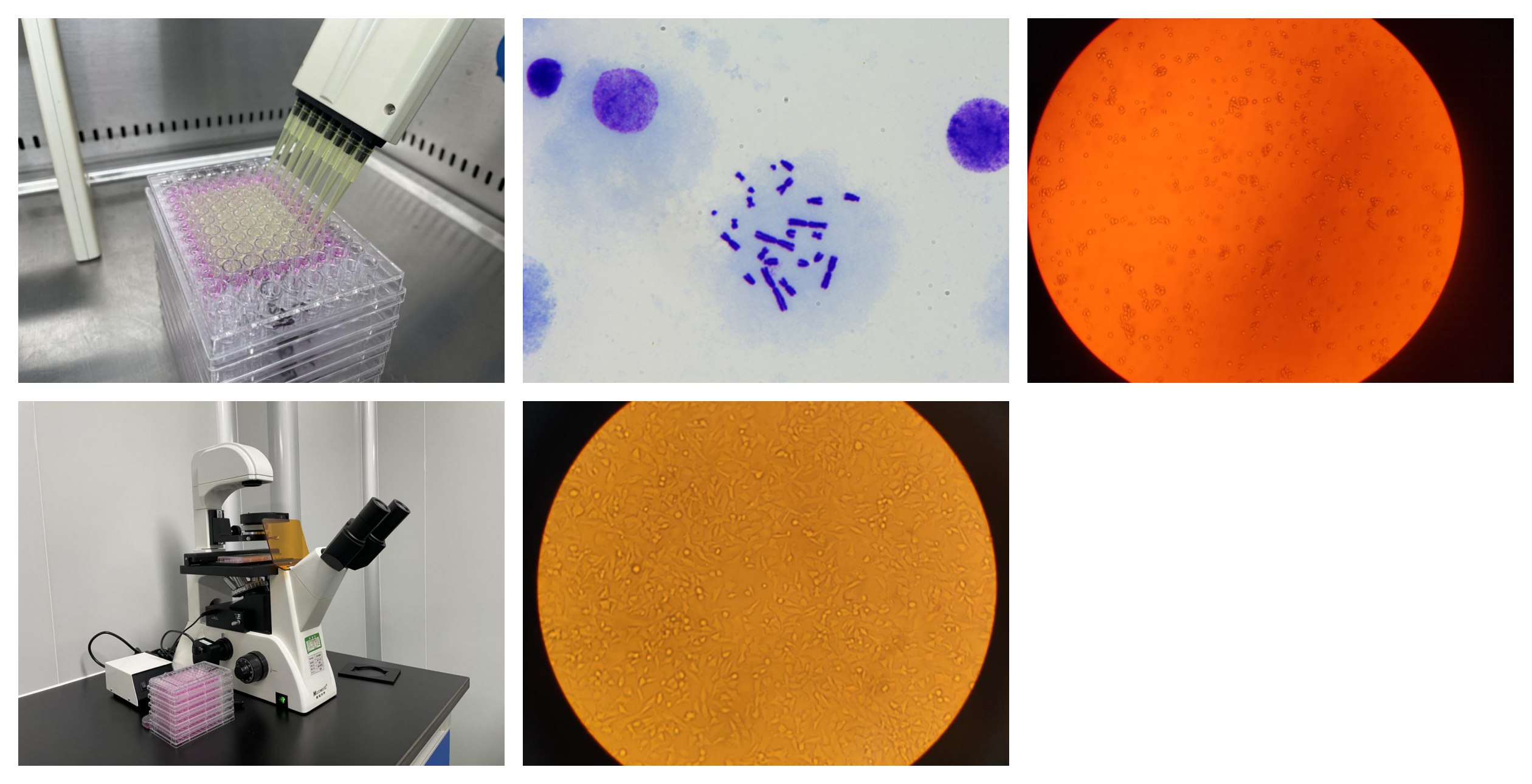
1.取营养肉汤培养基5mL,加入无菌小三角瓶或无菌试管中,将主平板或冷冻保存的菌株培养物接种于营养肉汤培养基内,在(37±1)℃、(115r/min~125 r/min)振荡培养10h~12h至对数生长期,活菌数不少于1×109cfu/mL。融化顶层培养基分装于无菌小试管,每管2mL,在45℃水浴中保温。
2.在保温的顶层培养基中依次加入样品液0.1ml、新鲜细菌培养物0.1ml和10%S9混合液0.5mL。无活化组加入0.2mol/L磷酸盐缓冲液0.5mL。试管内容物混合后铺至最低琼脂营养平板的表面。在培养前待顶层琼脂固化。样品组分别设三个平行皿。
3. 阴性对照组分别加入0.1mL浸提介质和新鲜细菌培养物0.1ml,活化组再加10%S9混合液0.5mL,无活化组加0.2 mol/L磷酸盐缓冲液0.5mL;阳性对照组分别加入诱变剂0.1mL和新鲜细菌培养物0.1ml,活化组再加10% S9混合液0.5mL,无活化组加入0.2mol/L磷酸盐缓冲液0.5mL。阴性及阳性对照组分别设三个平行皿。全部平皿置37℃倒置培养48~72h观察结果。
体外哺乳动物染色体畸变试验:
1、试验分为短期接触组(有和无代谢活化系统)和长期接触组(无代谢活化系统)。短期接触组接触4h,长期接触组接触24h。
2.接触处理:试验前接种一定数量细胞,置于二氧化碳培养箱培养。一天后弃培养液,0.9%氯化钠注射液组加入对照品或供试品、S9混合液(不加S9混合液时,需用培养液补足)以及培养液。0.9%氯化钠注射液浸提液的终浓度为10%。含血清培养基组加入对照品或供试品、S9混合液(不加S9混合液时,需用培养液补足)。全部置于37℃二氧化碳培养箱中。短期接触组接触结束后吸去培养皿中的液体,用PBS清洗细胞3次,加入含血清培养基继续培养。于24h内收获细胞,收获前4h加入终浓度为1μg/mL秋水仙素。阴性对照组和阳性对照组同法制备。
3.收获细胞与制片:消化细胞后加含血清培养液收集细胞。加入0.075mol/L氯化钾溶液低渗处理后,加入固定液(甲醇:冰醋酸,3:1混合)进行固定,固定结束后离心弃上清,加入数滴新鲜固定液滴片,空气干燥后用姬姆萨染液染色。
4.结果评价:在光学显微镜下每一试验组选择300个分散良好的中期分裂相细胞进行染色体畸变分析,记录畸变细胞数。
小鼠淋巴瘤细胞(TK)基因突变试验:
1、 接触处理:取生长良好的细胞,调整密度为1×106/mL,无活化系统组取10mL细胞悬液与9mL试验或对照样品以及150mmol/L氯化钾溶液1mL混合;有活化系统组取10mL细胞悬液,加入9mL试验或对照样品以及S9混合液,37℃震摇处理4小时(有和无活化系统)和24小时(无活化系统)。振荡频率为(70~80)r/min。处理结束后离心,弃上清液,用PBS 或不含血清的培养基洗涤细胞2 遍,重新悬浮细胞于含10%胎牛血清的RPMI 1640 培养液中,并调整细胞密度为2×105/mL。
2. PE0平板:PE0(0 天的平板接种效率)测定:取适量细胞悬液,作梯度稀释至8 个细胞/mL,接种96 孔板(每孔加0.2mL,即平均1.6 个细胞/孔),每个剂量作2块板,37℃,5% CO2,饱和湿度条件下培养12d,计数每块平板有集落生长的孔数。
3. PE2平板:第2d表达培养结束后,按PE0接种。每天计数细胞密度并保持密度在106/mL 以下。
4. TEF拮抗平板:第2d 表达培养结束后,取适量细胞悬液,调整细胞密度为1×104/mL,加入TFT(三氟胸苷,终浓度为3μg/mL),混匀,接种96 孔板(每孔加0.2 mL,即平均2000 个细胞/孔),每个剂量作2块板,37℃,5% CO2,饱和湿度条件下培养12d,计数有突变集落生长的孔数。
5. 结果评价:对每块平板计算无集落生长的孔数,对TFT抗性拮抗平板应计算无小集落孔数、无集落孔数。每个剂量组数据求平均数,

哺乳动物骨髓红细胞微核试验:
1.选用50只体重在25~30g范围内的SPF级KM小鼠,分为5组,每个剂量组10只,雌雄各半。
2. 动物染毒采用两次腹腔注射或尾静脉注射,连续2d,即两次染毒间隔24h,第二次染毒后6h取材。注射量为20mL/kg。
3. 用颈椎脱臼法处死动物,取出股骨。剔除肌肉等组织,擦净血污。剪去股骨两端,暴露骨髓腔。
4. 用注射器吸取0.1mL胎牛血清,冲洗骨髓腔。用冲洗液常规涂片,晾干或烘干。
5. 将干燥的涂片放入甲醇中固定5~10min,将固定过的涂片放入Giemsa 应用液(1份Giemsa储存液:6份1/15mol/L 磷酸盐缓冲液混合而成,临用现配),染色10~15min,然后用pH6.8 PBS液冲洗,晾干。
6. 在油镜下观察观察计数含微核的嗜多染红细胞(PCE)数以及观察PCE/NCE(写好标签成熟红细胞)的比例。每只动物计数1000个PCE,计算微核细胞率,以千分率表示。试验数据用泊松分布方法进行统计学处理。同时,计数200个PCE,并记数所见到的NCE。
7. 阳性与阴性对照组的操作程序同供试品组。
| 检测对象 | 项目 | 检测标准(方法) |
|---|---|---|
| 医 疗 器 械 | 遗传毒性试验 | 医疗器械生物学评价 第3部分:遗传毒性、致癌性和生殖毒性试验 GB/T 16886.3-2019 |
| 医疗器械生物学评价 第3部分:遗传毒性、致癌性和生殖毒性试验 ISO 10993-3:2014 | ||
| 医疗器械遗传毒性试验 第1部分:细菌回复突变试验 YY/T 0870.1-2013 | ||
| 医疗器械遗传毒性试验 第2部分:体外哺乳动物细胞染色体畸变试验 YY/T 0870.2-2019 | ||
| 医疗器械遗传毒性试验 第3部分:用小鼠淋巴瘤细胞进行的TK基因突变试验 YY/T 0870.3-2019 | ||
| 医疗器械遗传毒性试验 第4部分哺乳动物骨髓红细胞微核试验 YY/T 0870.4-2014 | ||
| 口腔医疗器械生物学评价 第2单元:试验方法 鼠伤寒沙门氏杆菌回复突变试验(Ames试验) 口腔医疗器械生物学评价 第17部分:小鼠淋巴瘤细胞(TK)基因突变试验 YY/T 0127.17-2014 | ||
| 医用有机硅材料生物学评价试验方法 GB/T 16175-2008 5 |